人才强校 | 中国农大龙少军教授团队在弓形虫微孔介导营养摄取机制方向取得重要进展
中国农大新闻网讯 2月22日,《自然-通讯》(Nature Communications)在线发表了中国农业大学动物医学院龙少军教授团队的研究论文《弓形虫微孔介导选择性摄取宿主营养的内吞作用》(The Toxoplasma micropore mediates endocytosis for selective nutrient salvage from host cell compartments)。该项工作深入研究弓形虫中质膜特有结构-微孔的蛋白质组构成和虫体在宿主细胞寄生和致病中的功能。该研究解析了微孔构成蛋白质、以及其蛋白质互作网络,明确了核心蛋白Kelch13介导的蛋白复合体控制微孔结构的稳定性、以及内吞作用过程摄入宿主胞质物质和高尔基体成分,并调控虫体中线粒体的代谢活动。

弓形虫是重要人兽共患原虫,在众多动物和人类中传播,导致急性和慢性弓形虫病。由于便于实验研究,弓形虫也是顶复亚门原虫研究的重要模式生物。弓形虫在胞内寄生和致病过程中,营养成分严重依赖于宿主细胞,这些营养包括常规代谢产物、脂类、糖脂、维生素、调控因子、以及宿主细胞中的大分子物质等。因此,为实现其在宿主细胞内的寄生、增殖和分化等致病活动过程,弓形虫必须从宿主细胞获取相关营养成分。多年来,学界认为弓形虫和相近原虫中可能不存在真核生物中常见内吞作用机制,虽然早在1964年就发现虫体质膜上存在特殊的凹陷结构-微孔。然而,经典的网格蛋白依赖内吞作用(clathrin mediated endocytosis, CME)关键蛋白,如clathrin,AP2 beta亚基、ENTH蛋白定位于高尔基体,参与毒性因子细胞器蛋白的分选,而使相应过程一直存疑。
为探究弓形虫营养获取机制,回答弓形虫模式生物中内吞作用机制存在的可能性,龙少军教授团队全面分析了弓形虫基因组中潜在内吞相关蛋白、以及包含相关结构域蛋白,并结合高效蛋白质组技术-生物素邻近标记技术,发现和鉴定了系列蛋白,这些蛋白定位于特定的虫体外周点状结构。采用高清晰显微和免疫电镜技术,明确了顶复门原虫内高度保守蛋白Kelch13在微孔高致密环中,而电镜显微重构技术观察到了微孔基部出芽,形成内吞泡(图1)。这些数据说明上述新蛋白定位于微孔,并且该结构以内吞作用的方式向虫体内形成内吞泡。
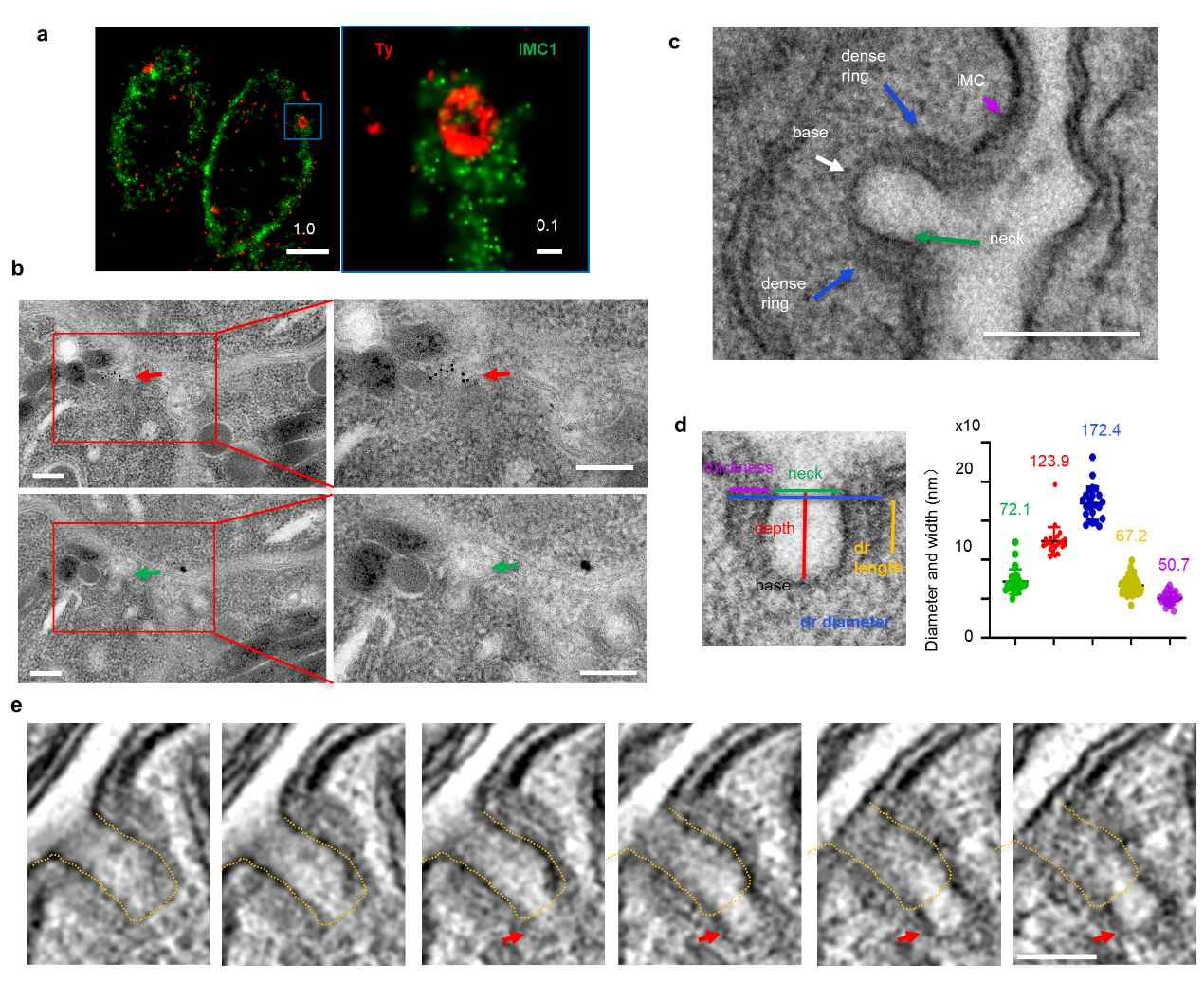
图1. 弓形虫质膜特有结构-微孔关键蛋白鉴定以及结构分析
蛋白质组技术结合生物信息学分析鉴定了新蛋白互作关系、以及Kelch13在互作网络中的核心地位,而全面的条件性蛋白质敲低实验为此提供了进一步证据(图2)。Kelch13条件性敲低导致虫体无法在体外和体内生长,而其余蛋白相对而言影响要小。为深入解析相关蛋白质和该结构的功能,课题组采用生理、生化、荧光显微、转录组、代谢组、以及亚细胞电镜结构分析,明确了关键蛋白在虫体摄入宿主细胞质蛋白(如GFP)、生物素、以及高尔基体神经酰胺中的功能,进一步在透射电镜和扫描电镜明确相关蛋白对微孔结构的影响。令人奇怪的是,微孔蛋白可显著影响虫体内线粒体活性,这与疟原虫Kelch13介导的青蒿素耐药不谋而和,正如评审专家提议的可从弓形虫微孔角度研究疟原虫中青蒿素耐药机制。
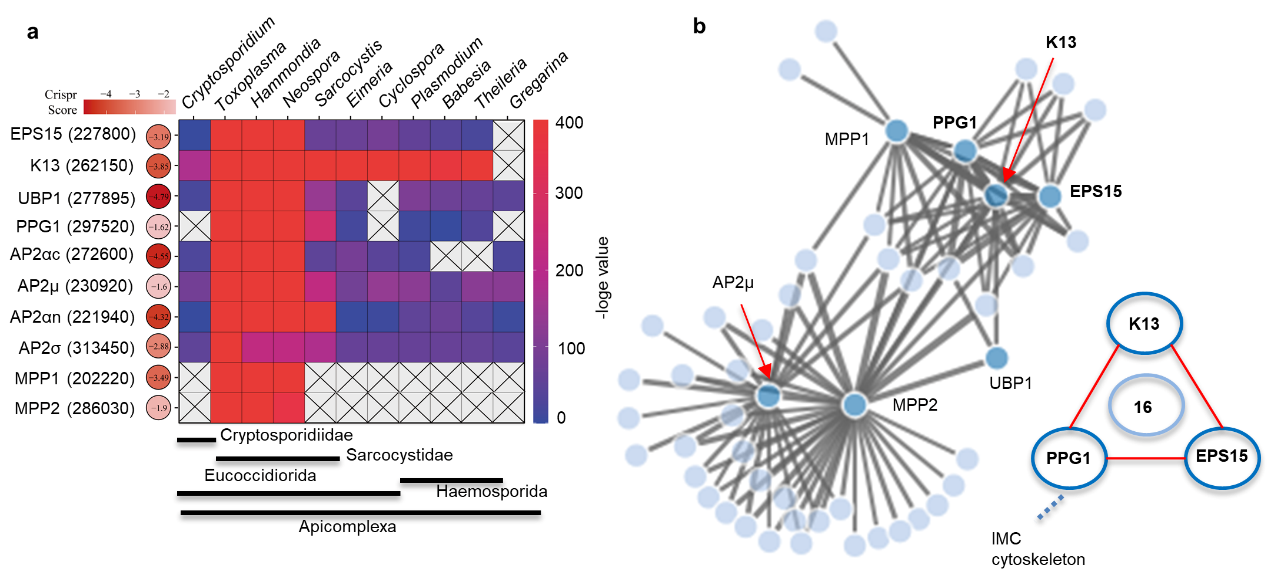
图2.弓形虫微孔蛋白保守性和互作关系网络分析
这项工作是弓形虫在胞内寄生获取宿主细胞营养领域内的重要进展,确认了弓形虫可利用虫体特有细胞结构摄入宿主细胞中的营养成分,这些工作也是弓形虫与宿主细胞互作关系中的重要内容和新研究方向。然而,更多更重要的科学问题有待解析,包括内吞泡定向运输至消化细胞器的分子基础和调控机制、弓形虫获取宿主细胞线粒体和内质网营养的机制等前沿科学问题。因此,该项工作为课题组深入开展相关研究提供了新视角和新理论,为课题组持续在该领域内开展创新性研究积累了科研经验和研究方向。
中国农业大学龙少军教授为该论文通讯作者,博士生万文妍和董辉,以及赖德华副教授为并列第一作者。龙少军教授长期与国内多家单位和国际著名寄生虫学课题组保持合作关系,有力促进了相互学术交流和课题的研究和发展。本研究获得国家自然科学基金面上项目(31873009)等课题支持。
原文链接:https://www.nature.com/articles/s41467-023-36571-4
供稿:动物医学院
供图:动物医学院
编辑:李杨
责编:武慧媛
